慢性轻度 炎症 :微营养管理替代药物治疗
/0 评论/在: Feature /通过: 管理员, 网站安娜玛丽·罗素(Anne-Marie Roussel)
格勒诺布尔阿尔卑斯大学名誉教授

简介
炎症 反应与免疫反应密不可分,是人体防御系统对攻击(物理攻击、细菌或病毒、化学物质、免疫反应产生的化合物)的复杂反应(免疫复合物、细胞毒性抗体、细胞因子等) 。
当反应适应,控制和时间限制时,它对我们的生存至关重要。 另一方面,由于促炎因子和抗炎因子之间的不平衡,它可能会变成慢性,适应不良和攻击性疾病(图1)。
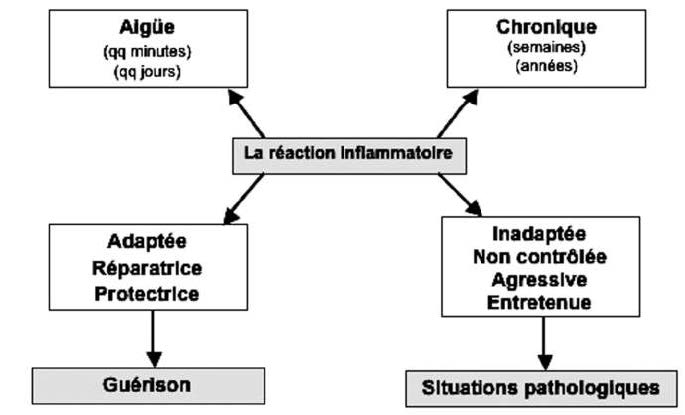
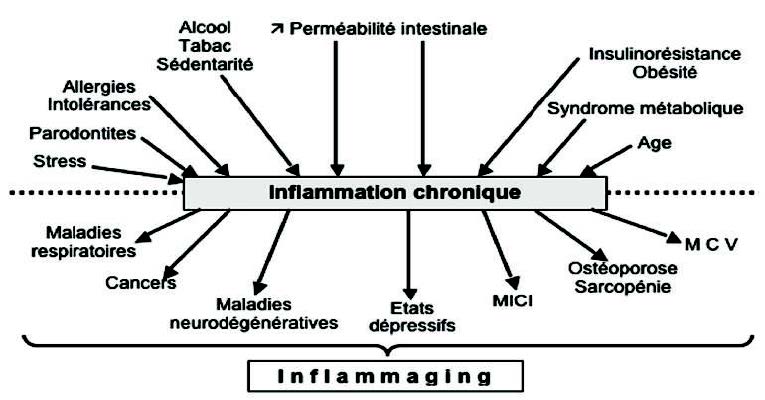
然后,慢性轻度炎症会悄悄演变成为许多疾病(如糖尿病、心血管疾病、自身免疫性疾病、炎症性肠病IBD、抑郁症等)出现和/或加重的主要危险因素,比如呼吸系统疾病、神经退行性疾病,甚至癌症…(图2)。
传统上,抑制炎症的脂质介质产生的非甾体抗炎药(NSAID)已被广泛使用。 然而,这类治疗并非没有副作用,主要是引起胃肠道的侵蚀和肠通透性的增加(1)。
作为这些经典药物治疗的替代方法,我们获得了具有抗炎特性的生物活性分子的新数据。 这些天然存分子的作用机理已经被确定,其中一些以前已知,而最近进行了研究。 由于没有副作用,生物活性化合物在抗炎策略中占有特殊的位置。
1. Rappels biochimiques: les principaux acteurs de la réponse inflammatoire et les mécanismes de l’inflammation
炎症反应和炎症机制的主要参与者
免疫细胞、前哨细胞或循环细胞在刺激或侵略下会被激活,同时触发细胞机制产生炎症介质。
先天免疫的细胞受体在触发炎症反应中的作用
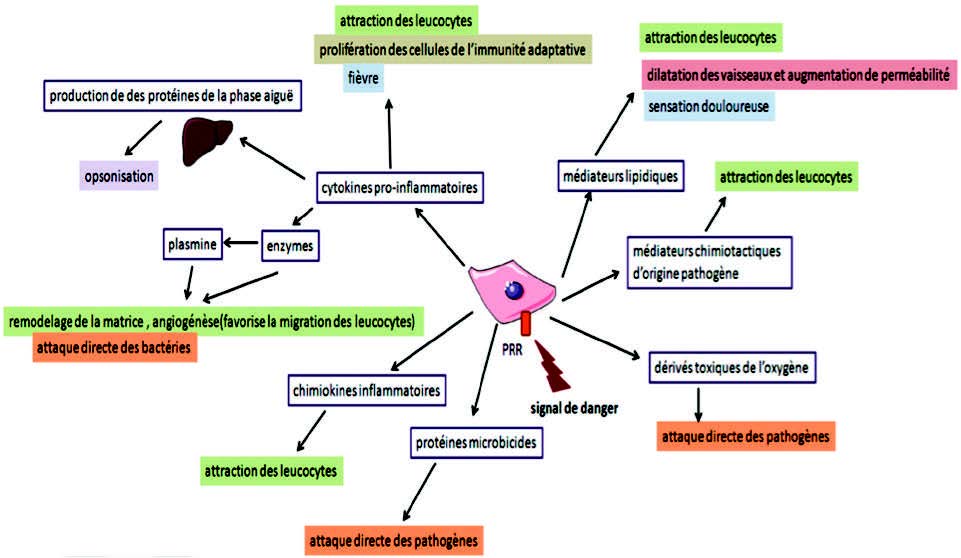
驻留在组织中的前哨免疫细胞(肥大细胞,巨噬细胞和树突状细胞)通过其膜类型“模式识别受体”(PRR)感知到危险信号(DAMP)或致病模式(PAMP)的存在, 特别是Toll样受体(TLR)。 该反应的功能后果是募集循环细胞(嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、自然杀伤细胞以及T和B淋巴细胞),消除侵略性(例如吞噬作用)和/或修复病变(细胞外基质的重塑)。
信号从细胞外介质传输到核室
广义地说,最近描述的炎症分子机制是基于激活的:
– 一系列磷酸化反应(激酶的级联反应),可诱导核转录因子(如NF-kB和AP1)的产生,控制促炎性介质(TNFα,细胞因子等)的基因表达,
– 诱导白介素(IL-1)合成的炎症小体蛋白,
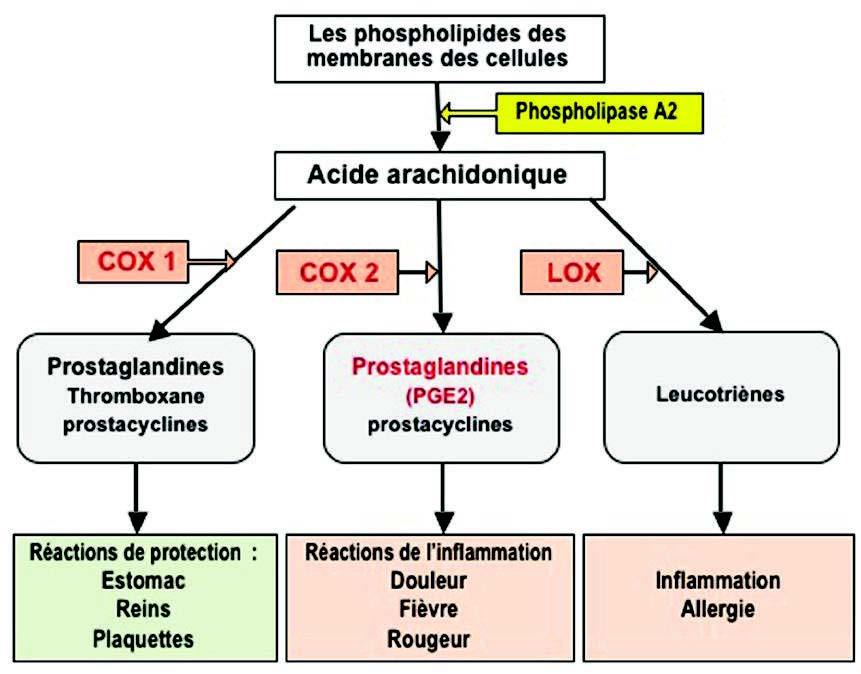
– 花生四烯酸的氧化代谢与前列腺素和促炎性白三烯的产生,
– NADPH氧化酶和诱导型NO合酶,一种可产生氧化和亚硝化物质的酶。
激酶的磷酸化级联反应(2)(图3)
由细胞质酶,蛋白激酶催化的一系列“级联”磷酸化反应是将炎症信号转导至核区室所必需的。 我们说“激酶的磷酸化级联”有几种途径,其中包括MAP激酶(促分裂原活化的蛋白激酶)、IKK和JAK / STAT的途径(Janus激酶和信号转导子和转录激活子)。
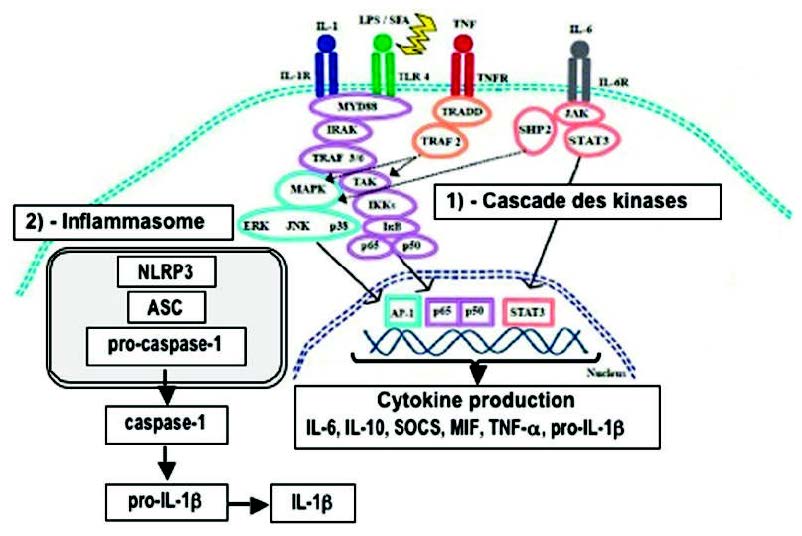
MAPKs(p38,JNK,ERK)和/或JAKs的磷酸化是调节促炎性细胞因子生物合成的关键因素。
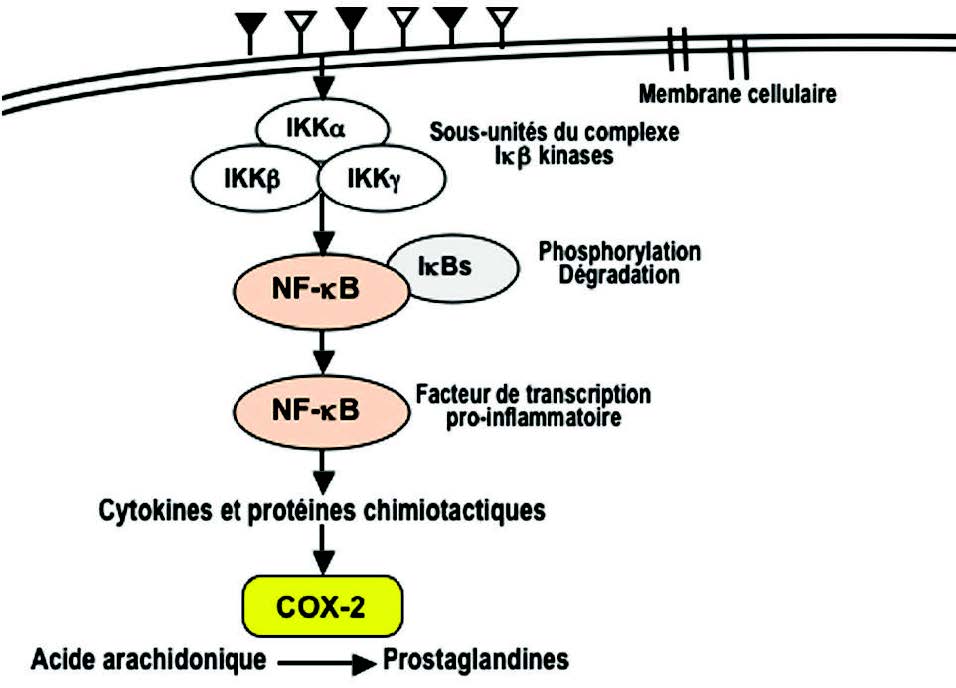
磷酸化激活其他信号因子(例如STATs,NF-kB,AP-1激活蛋白1)。这些底物是转录因子。它们迁移到细胞核以调节靶基因表达,进而编码促炎蛋白。因此,在磷酸化级联过程中从抑制蛋白(I-κB)释放的NF-κB(3)迁移到细胞核中,并在那里诱导基因表达,编码细胞因子(IL1β,TNFα,IL2 (6,8,12),对于花生四烯酸,磷脂酶A2(PLA2),环氧化酶(COX-2),脂氧合酶(5-LOX)的氧化代谢酶,或者对于活化亚基NADPH氧化酶,是一种产生氧化自由基的酶(4)(图4)。
因此,抗炎策略的主要目标是用激酶抑制磷酸化级联反应从而抑制促炎蛋白的产生。
炎性小体(5)(6)
炎性小体是由几种蛋白质组成的膜复合物,包括胱天蛋白酶1,胱天蛋白酶1在识别炎症信号后被蛋白质家族NLRP(Nod Like ReceptorProtein)激活。 迄今为止,已经描述了各种炎症小体,包括临床上与肥胖、胰岛素抵抗和轻度炎症有关的NLRP3(7)。 NLRP3半胱天冬酶1负责从无活性的前IL1β形成IL1β。抑制NLRP3是抗轻度炎症的优先选项。
炎症的调节因素(8)
许多体液和细胞介体(图5)含有细胞因子、前列腺素、白三烯、氧和氮的活化形式、神经肽、补体因子、凝血因子、甚至是金属蛋白酶。
我们在这里应了解:
- 激活NF-κB后,巨噬细胞、树突状细胞和肥大细胞产生TNFα(肿瘤坏死因子α)(9)。
- 信号由病原相关分子模式PAMP以非活性前体形式识别后,许多细胞(白细胞,成纤维细胞,内皮细胞)分泌IL1(白细胞介素1),通过半胱天冬酶1或ICE(白介素1β转化酶)(炎性小体中存在的膜蛋白酶)将无活性的前IL1β转化为IL1β。
- 炎症的脂质介质:
磷脂酶A2(PLA2)催化膜磷脂的水解和花生四烯酸的释放。花生四烯酸被环加氧酶(COX 1和2)和脂加氧酶(LOX)氧化为白三烯(LT)和前列腺素(PG)(图6)。这些化合物对嗜中性粒细胞和巨噬细胞具有趋化作用,并促进白细胞到达炎症部位。
- 氧气的活性形式:
NADPH氧化酶是一种催化分子氧还原为超氧阴离子(O2°-)的酶,从中可产生两种主要的氧化剂家族:氧的反应形式和氮的反应形式,尤其包括过亚硝酸盐(ONOO°)和亚硝胺。炎性信号的转导刺激NADPH氧化酶的细胞活性以及可诱导的一氧化氮合酶的细胞活性。
小结
通过阻断
- 促炎细胞因子的表达,
- 花生四烯酸(PLA2,COX-2和LOX-5)的氧化代谢酶的活性,
- NADPH氧化酶,iNOs的活性和氧化物质的增加,从而达到抗炎效果。
2. L’inflammation chronique de bas grade : l’ennemi silencieux : Quelles situations à risque ?(10)
慢性轻度炎症:沉默的敌人会带来哪些危险(10)
我们的饮食和生活方式造成促炎因子产生和抗炎平衡失衡,导致炎症反应的持续性。
图2所示,许多医生造成破坏性很强,无明显症状的炎症,例如消化道生态系统紊乱导致的肠道通透性增加(肠道渗漏)(11)、胰岛素抵抗、肥胖和代谢综合症(12)、抑郁状态(13)、衰老、关节退化(14)、牙齿问题(15)以及免疫功能或肝脏排毒功能下降。这些被称为“发炎”,与年龄相关的轻度发炎(16)。
某些长期的生活习惯,例如西式饮食富含饱和脂肪和糖,并且缺乏微营养(镁、锌、硒、维生素D、C、E、B6)(17)(18)、吸烟(19)、酒精、睡眠不足(20)、久坐的生活习惯(21)、压力(22)、环境污染(23)也会诱发慢性炎症。
在引起轻度炎症的主要因素中,应记住以下几点:
- 肠通透性过高,由消化粘膜破裂引起,是轻度炎症的主要原因(24)。
- 年龄,这也使我们面临持续的轻度炎症反应(25)。经过充分研究的“发炎”是病理性衰老和死亡率的预测因子(26)。骨质疏松、心血管疾病、抑郁症和神经退行性疾病(例如阿尔茨海默症)通常是老年人慢性炎症的病灶。
- 肥胖和代谢综合症,血糖失衡、胰岛素抵抗和脂肪组织的扩张而造成慢性炎症的主要原因(27)。在脂肪炎症中,免疫细胞、巨噬细胞和T淋巴细胞渗透到肥胖受试者的脂肪组织中,细胞因子的过度产生形成促炎性环境:巨噬细胞产生的IL1β和淋巴细胞产生的IL17和22(28)。巨噬细胞和淋巴细胞之间的相互作用促进肥胖患者脂肪组织中白三烯的分泌和慢性炎症(29)(30)。超重高瘦素血症与循环中的TNF-α,IL12,IL10和胰岛素水平相关,血液中瘦素水平升高是轻度炎症的标志(31)。
因此,将肥胖与高发病率的肥胖人群带病CVD、癌症、关节炎、认知能力下降、哮喘和呼吸系统疾病以及骨质疏松症的共同点就是超重引起的轻度炎症。
- 长期心理压力这也会产生轻度的神经炎症。NF-κB转录在慢性应激状态下被激活。激活这种炎症的脂质介体和氧化亚硝化物质的产生会导致组织损伤和神经元功能受损(32)。 在这种情况下,抑郁症是由一系列环境压力(社会压力、食物压力、身体压力、代谢压力)导致的一种轻度炎症性疾病(33)。
3. Les pathologies chroniques inflammatoires (figure 2)
慢性炎性病理(图2)
慢性炎性病理在各个年龄段都非常普遍,并且有明显迹象的爆发。在慢性炎症病理中,最重要的是耐受性疾病(食物不耐受、过敏)、自身免疫性疾病(克罗恩病、乳糜泻、白癜风、1型糖尿病、桥本甲状腺炎、多发性硬化症等)和呼吸系统疾病,例如哮喘。
现在普遍认同的是,炎症成分与动脉粥样硬化、癌症、神经退行性疾病和抑郁症密不可分,因为大脑非常容易发炎。
4. Quelle stratégie anti-inflammatoire ?
有什么消炎策略?
- 肠屏障的恢复:肠通透性的治疗是控制任何轻度炎症的前提和必要条件,肠粘膜是免疫系统部署其大部分防御体系的屏障。
- 改变环境因素:对抗轻度炎症还需要改变生活方式:健康的饮食习惯、减肥,规律的锻炼,压力管理,吸烟和戒酒。
- 欧米伽6 /欧米伽3摄入平衡:我们已经认识到,饮食的变化特征是过量摄入欧米伽6,欧米伽6 /欧米伽3摄入失衡会造成慢性炎症。
补充摄取高生物利用度的长链欧米伽3脂肪酸(甘油三酸酯)是很基本的,这对恢复肠屏障、抵抗慢性炎症也很重要。
- 抗炎生物活性化合物的支持:
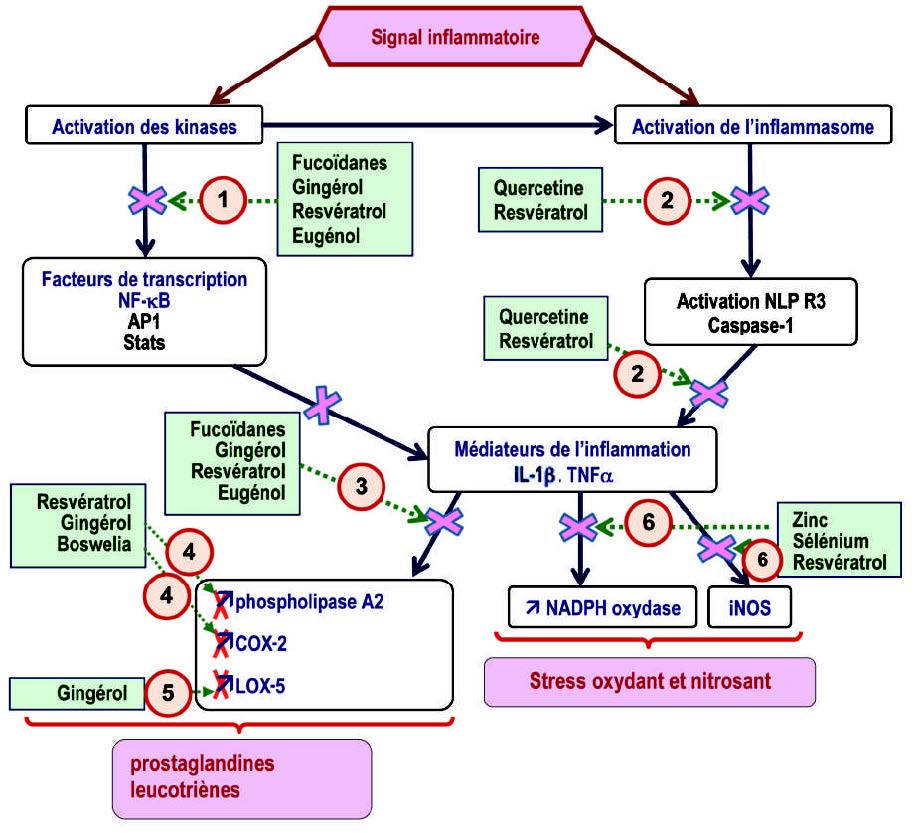
这种管理必须考虑到引起慢性炎症的不同机制,即
- 直接作用于激酶的级联反应,以阻断激酶的磷酸化和促炎基因的转录,尤其是由NF-kB,STAT和核AP-1诱导;
- 抑制编码炎性蛋白的基因,特别是胱天蛋白酶1,该基因负责产生IL1β,
- 阻断由花生四烯酸的氧化代谢导致的脂质介体产生的COX-2和5-LOX酶,
- 对抗氧化和亚硝化应激,因为氧化应激会导致炎症已得到科学证明。
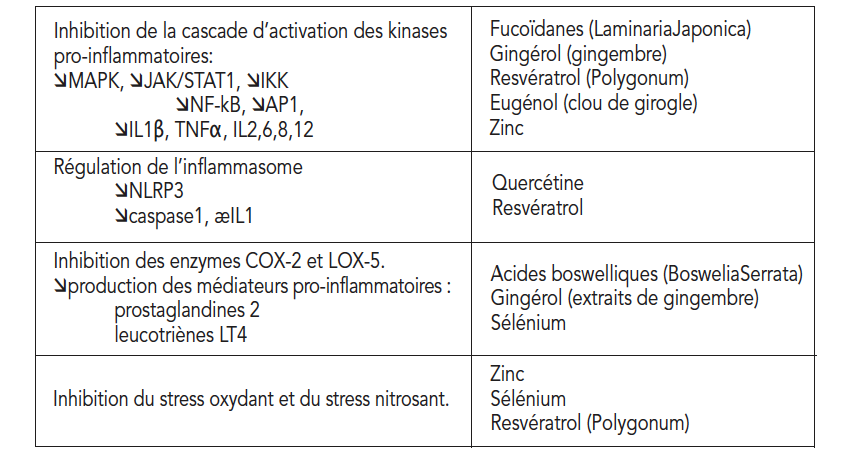
- 岩藻依聚糖作为激酶抑制剂
如上所述,激酶参与促炎级联反应现在是众所周知的。超过400种病理与蛋白激酶的激活直接或间接相关(34)(35)。
岩藻依聚糖是藻类中发现的海洋来源的硫酸多糖,已被鉴定为促炎性激酶级联的抑制剂。自1970年以来,它们一直是研究的主题,至今已有700多种出版物(36)(37)。
岩藻依聚糖抑制NF-κB的活性,同时抑制ERK,JNK(c-jun末端激酶)、P38 MAP激酶和AKT蛋白激酶的活性(38)。
岩藻依聚糖作为激酶抑制剂的剂量依赖性抗炎作用已体现在主动脉的脂肪细胞(39)和平滑肌细胞上,尤其是作为超重受试者针对动脉粥样硬化轻度炎症的保护机制(40)。
- 生姜中的多酚作为激酶和NF-κB,以及COX2和5-LOX的抑制剂
生姜(姜)含有丰富的生物活性酚类化合物,例如姜辣素、姜烯酚。它们是环加氧酶2(COX2)的有效抑制剂,部分解释了它们的抗炎特性(41)。生姜提取物还调节激酶级联反应,提示除COX-2抑制作用外,还有几种互补的抗炎作用机制(42)(43)。摄入姜或富含姜醇的提取物的益处已在几种炎性情况中得到了描述(44)(45):类风湿关节炎(一种慢性炎症为特征的自体免疫疾病),导致骨骼和软骨不可逆性损坏(46),在肥胖的成年人和2型糖尿病患者中,轻度炎症在3个月后显着减少(血浆TNF-α,超敏CRP和IL6降低)(47)(48)(49)。
- 槲皮素、白藜芦醇作为炎症小体蛋白和激酶的联合抑制剂
槲皮素与芦丁是最活跃的类黄酮之一。它是抗氧化剂和抗炎药,其作用机理仅是部分已知的。炎性体似乎是槲皮素的主要靶标。最近研究表面槲皮素(50)具有在体内阻断炎性体NLRP3的蛋白表达(50)以及对激酶级联的调节作用,减少MAPKs活化的能力(51)。
与这些特性相一致,成人高血压患者补充4周后,轻度炎症生物标记物得到改善(52)。
白藜芦醇:摄入白藜芦醇的好处在慢性炎症病理学中是众所周知的(53)。像槲皮素一样,白藜芦醇作用于激酶级联反应和炎性小体。白藜芦醇阻断NF-κB生成激酶,并抑制NLRP3炎性小体的激活步骤和相关的IL1β分泌(54)(55)(56)。对于人类而言,摄入白藜芦醇具有抗炎作用,已有多项研究报道:患有慢性炎症的高血压或2型糖尿病患者,补充1年白藜芦醇还可以改善炎症标志物(57)(58)。最后,健康的受试者在膳食中添加白藜芦醇后,可以显著减少脂肪和甜食引起的慢性餐后炎症(59)。
- 丁香酚和异丁香酚作为MAPKs和NF-kB抑制剂
丁香的两个成分,丁香酚和异丁香酚也是强大的抗氧化剂和消炎药。它们联合抑制MAPK,Akt / IkB信号传导和NF-κB产生。该机制在巨噬细胞(60)和动物模型中,针对变应性哮喘(61)、肝炎(62)和关节炎(63)的效果已得到证明。
- 乳香酸
乳香酸,从齿叶乳香树脂中提取的乙酰基-11-酮-β-乳香酸(AKBA)是有效的消炎药(64)。乳香酸通过几种保护机制影响免疫功能和炎性反应:抑制NF-κB的激活,从而抑制TNFα的激活,降低IL1,2,4,6和IFNγ,抑制补体系统,因为阻止C3向C3a和C3b的转化,阻止白三烯的产生。乳香酸在慢性炎症中的作用机制是通过阻断负责促炎性白三烯产生的脂加氧酶(LOX-5)的活性,以及抑制软骨中的糖胺聚糖降解酶(65)来实现的。在肠道炎症模型中,乳香酸(主要是AKBA)可通过防止蛋白质(闭合蛋白)降解来抑制NF-κB的活化,从而起到修复紧密连接并保护肠粘膜的作用。
它们可有效治疗慢性风湿性疼痛(67)、肠道(68)和呼吸道(69)发炎。
据观察,这些机制的互补性解释了在慢性炎症(包括类风湿性关节炎、支气管哮喘、溃疡性结肠炎和克罗恩病)中的积极作用(70)。
- 必需的微量元素锌和硒作为抗氧化剂和消炎剂
几项流行病学研究报告说,血浆硒水平与炎症疾病之间存在负关系,而硒的抗炎作用机理尚不完全清楚(71)。抗氧化剂硒蛋白调节类花生酸的表达(72),并减少促炎蛋白(iNOs、TNFα和COX-2)的表达和产生。
在临床上,通过补充硒可以改善哮喘、多囊综合征、炎症性肠病、结肠炎和过敏症中的炎症指标。
锌缺乏伴有免疫功能障碍和慢性炎症,尤其会激活IL6合成(73)。补锌会阻止NADPH氧化酶和促氧化剂物质的产生,参与NF-κB的失活并降低促炎细胞因子的水平,对慢性炎性疾病(如动脉粥样硬化、癌症、神经退行性疾病、2型糖尿病和自身免疫性疾病(74)。
总结
岩藻依聚糖,多酚和微量元素的组合在所有细胞炎性信号传递途径和产生炎症介质的代谢上均具有协同活性(表1)。
这些抗炎作用机制与对欧米伽3/欧米伽6平衡对肠道通透性的控制相结合,可提供最佳的作用互补性,以对抗慢性轻度炎症(图7)。
词汇表
DAMP:危险相关分子模式 |
PAMP:病原体相关的分子模式 |
PRR:模式识别受体 |
TLR:Toll 样受体 |
MAPK:丝裂原激活的蛋白激酶 |
JAK:Janus激酶信号 |
STAT:信号转导子和转录激活子 |
NFkB:核因子活化B细胞κ轻链增强子 |
AP-1:激活蛋白1 |
NLRP:点头样受体蛋白 |
COX-2:诱导型环氧合酶 |
LOX-5:5种加氧酶 |
LT:白三烯 |
PG:前列腺素 |
IL:白介素 |
参考文献
- Moore N et al. Adverse drug reactions and drug-drug interactions with over-the-counter NAIDs. 与非处方非甾体抗炎药的不良药物反应和药物相互作用 Ther Clin Risk Manag. 2015; 11:1061-75.
- Patterson H et al. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases. 蛋白激酶抑制剂在炎性和自身免疫性疾病的治疗中的使用Clin Exp Immunol. 2013; 176:1-10.
- Hinz M et al. the IkBkinase complex in NF-kB regulation and beyond; IkB激酶复合物在NF-kB调控中的作用 EMBO rep. 2014; 15(1):46-61.
- Ledoux AC et al. NF-kB and the cell cycle. NF-kB与细胞周期Biochem Soc Trans. 2014; 42(1):76-81.
- Latz E et al. Activation and regulation of the inflammasomes. 炎症小体的活化和调节 Nat Rev Immunol; 2013; 13(6).
- Lamkanfi M et al. Mechanisms and functions of inflammasomes. 炎症小体的机制和功能Cell. 2014; 157:1013-1022.
- Abderrazak A et al. NLRP3 inflammasome: From a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases. NLRP3炎症小体:从危险信号传感器到氧化应激和炎症性疾病的调节节点Redox Biol. 2015; 4:296-307.
- Henrotin Y et al. Les médiateurs biochimiques de l’inflammation. 炎症的生化介质Rev Med Liege. 2001; 56:6:433-442.
- Lawrence T. The nuclear Factor NF-kB pathway in inflammation. 炎症中的核因子NF-kB途径 Cold Spring Harb Perspect Biol. 2009; 1(6).
- Minihane AM et al. Low-grade inflammation, diet composition and health: current research evidence and its translation. 轻度炎症、饮食组成和健康:最新研究证据及其翻译Br J Nutr. 2015; Jul 31:1-14.
- Barbara G et al. A role for inflammation in irritable bowel syndrome? 炎症在肠易激综合症中起作用?Gut 2002; 51 Suppl 1:i41-4.
- Chen L et al. Mechanisms linking inflammation to insulin resistance. 炎症与胰岛素抵抗相关的机制 Int J Endocrinol. 2015; 2015:508409.
- Zalli A et al. Low-grade inflammation predicts persistence of depressive symptoms. 轻度炎症预示着抑郁症状的持续存在 Psychopharmacology. 2015 ; Apr16.
- Singh A, karrar S. The role of intracellular organisms in the pathogenesis of inflammatory arthritis. 细胞内生物在炎症性关节炎发病中的作用 Int J Inflam. 2014; 2014:158793.
- Podzimek S et al. C reactive protein in peripheral blood of patients with chronic and aggressive periodontitis, gingivitis and gingival recessions; 性和侵袭性牙周炎、牙龈炎和牙龈退缩的患者外周血C反应蛋白Mediators Inflamm. 2015; 2015:564858 .
- Baylis D et AL understanding how we age: Insights into inflammaging. 洞悉炎症 Longev Health Span. 2013; 2(1):8.
- Thornburn AN et al. Diet, metabolites and western life style inflammatory diseases. 饮食、代谢物和西方生活方式的炎症性疾病Immunity. 2014; 40(6):833-42.
- Lopez-Alarcon M et al. Excessive refined carbohydrates and scarce micronutrients intakes increase inflammatory mediators and insulin resistance in prepubertal and pubertal obeses children independently of obesity. 青春期前和青春期肥胖儿童中过量摄入的精制碳水化合物和微量营养素摄入不足会增加炎症介质和胰岛素抵抗,而与肥胖无关Mediators Inflamm. 2014; 2014:849031.
- Aldaham S et al. Smoking status effect on inflammatory markers in a randomized trial of current and former heavy smokers. 在现有和以前的重度吸烟者的随机试验中,吸烟状态对炎症标志物的影响 Int J Inflam. 2015; 2015:439396.
- Troester N et al. Sleep related breathing disorders and inflammation. The missing link? A cohort study evaluating the interaction of inflammation and sleep related breathing disorders and effects of treatments. 睡眠相关的呼吸障碍和炎症。缺少相关性? 一项队列研究,评估炎症与睡眠相关的呼吸障碍的相互作用以及治疗效果 PLoS One. 2015; 10(9):e0137594.
- Pruimboom L et al. Physical activity protects against metabolic stress induced by a post prandial and chronic inflammation. 体育锻炼可防止餐后和慢性炎症引起的代谢压力. Behav Neurol. 2015; 2015:569869
- Gouin JP et al. Chronic stress, daily stressors, and circulating inflammatory markers. 慢性压力、日常压力和循环炎症标记 Health Psychol. 2012; 31(2):264-8.
- Mostafavi et al. Inflammatory markers in relation to long term air pollution. 与长期空气污染有关的炎症标志 Environ. Int. 2015; 81:1-7.
- Sung HL; Intestinal permeability regulation by tight junction: implication on inflammatory bowel diseases. 紧密连接调节肠道通透性:对炎症性肠病的影响 Intest Res. 2015; 13(1):11-18.
- Shaw AC et al. Age-dependent dysregulation of innate immunity. 先天性免疫的年龄依赖性失调 Nature Rev Immunol. 2013; 13,875-887.
- Franceschi C, Campisi J. Chronic inflammation (inflammaging) and its potential contribution to ag-associated diseases. 慢性炎症(发炎)及其与年龄相关疾病的潜在贡献 J Gerontol A Biol Sci Med Sci. 2014; 69 Suppl 1: S4-9.
- Apostopoulos V et al. The complex immunological and inflammatory network of adipose tissue in obesity.肥胖中脂肪组织的复杂免疫和炎症网络 Mol Nutr Food Res. 2015 September.
- Izaola O et al. Inflammation and obesity (lipoinflammation). 炎症和肥胖(脂肪炎症)Nutr Hosp. 2015; 31(6):2352-8.
- Dalmas E et al. T cell-derived IL22 amplifies IL1beta driven inflammation in human adipose tissue: relevance to obesity and type 2 diabetes. T细胞衍生的IL22放大人脂肪组织中IL1beta驱动的炎症:与肥胖和2型糖尿病的相关性 Diabetes. 2014; 63(6):1966-77.
- Neels JG. A role for 5-lipoxygenase products in obesity-associated inflammation and insulin resistance. 5-脂氧合酶产品在肥胖相关的炎症和胰岛素抵抗中的作用 Adipocyte. 2013; 2(4):262-5.
- Leon-Cabrera S et al. Hyperleptinemia is associated with parameters of low-grade systemic inflammation and metabolic dysfunction in obese human beings. 高瘦素血症与肥胖者的轻度全身性炎症和代谢功能障碍相关 Front Integr Neurosci. 2013; 7:62.
- Munhoz CD et al. Stress-induced neuro-inflammation: mechanisms and new pharmacological targets. 应激诱导的神经炎症:机制和新的药理目标 Braz J Med Biol Res. 2008; 41(2):1037-46.
- Berk M et al. So depression is an anti-inflammatory disease, but when does the inflammation come from? 抑郁症是一种抗炎性疾病,但是炎症是什么时候产生的呢?BMC Med; 2013; 12:200.
- Kontzias A et al. Kinase inhibitors in the treatment of immune-mediated disease 激酶抑制剂在免疫介导疾病的治疗中; Med Rep. 2012; 4:5.
- Asadullah K et al. Protein kinase inhibitors for the treatment of inflammation- an overview. 蛋白激酶抑制剂治疗炎症-概述 Antiinflamm Antiallergy Agents Med Chem. 2007; 6:3-4.
- Fitton JH. Therapies from fucoidan: multifunctional marine polymers 岩藻依聚糖的治疗方法:多功能海洋聚合物; Mar Drugs. 2011; 9(10):1731-1760.
- Cumashi A et al. A comparative study of the anti-inflammatory, and antiadhesive activities of nine different fucoidans from brown seaweeds. 九种褐藻海藻岩藻聚糖的抗炎和抗黏附活性的比较研究 Glycobiology. 2007; 17:541-552.
- Park HY et al. Antiinflammatory effects of fucoidan through inhibition of NF-kB, MAPK and AKT activation in LPS-induced BV2 microglia cells. 岩藻依聚糖通过抑制LPS诱导的BV2小胶质细胞的NF-kB,MAPK和AKT活化而具有抗炎作用 Food Chem Toxicol. 2011; 49(8):1745-52.
- Kim KJ et al. Fucoidan, a sulfated polysaccharide, inhibits adipogenesis through the mitogen-activated protein kinase pathway in 3T-L1 preadipocytes. 岩藻依聚糖是一种硫酸化多糖,可通过3T-L1前脂肪细胞中的促分裂原活化蛋白激酶途径抑制脂肪形成。Life Sci; 2010; 86(21-22):791-7.
- Religa P et al. Fucoidan inhibits smooth muscle cell proliferation and reduces MAPK activity. 岩藻依聚糖抑制平滑肌细胞增殖并降低MAPK活性 Eur J Vasc Endovasc Surg. 2000; 20(5):419-26.
- Van Breemen RB et al. Cyclooxygenase-2 inhibitors in ginger (Zingiber officinale). 生姜中的环氧合酶2抑制剂(姜)Fitoterapia. 2011; 82(1):38-43.
- Grzanna R et al. Ginger, an herbal medicinal product with broad anti-inflammatory actions. 生姜,具有广泛的抗炎作用的草本植物 J Med Food 2005; 8(2):125-132.
- Lee TY et al. 6 gingerol inhibits ROS and iNOS through the suppression of PKC-alpha and NFkappaB pathways in LPS stimulated mouse macrophage. 6-姜油醇通过抑制LPS刺激的小鼠巨噬细胞中的PKC-alpha和NFkappaB途径抑制ROS和iNOS Biochem Biophys Res Comm; 2009; 382(1):134-139.
- Wang S et al. Biological properties of 6-gingerol: a brief review 6-姜油醇的生物学特性:简要评述. Nat Prod Commun. 2014; 9(7):1027-30.
- Singletary K. Ginger, an overview of health benefits. 生姜,对健康的益处概述 Nutrition Today. 2010; 45:4,171-183.
- Al-Nahain A et al. Zingiber officinale: A potential plant against rheumatoid arthritis; 生姜:一种有抗风湿性关节炎潜力的植物Arthritis 2014; 2014:159089.
- Atashak S et al. Obesity –related cardiovascular risk factors after long-term resistance training and ginger supplementation; 肥胖 -长期阻力训练和补充生姜相关的心血管危险因素 J sports Sci Med. 2011; 10(4):685-91.
- Mahluji S et al. Antiinflammatory effects of Zingiber officinale in type 2 diabetic patients. 生姜对2型糖尿病患者的抗炎作用 Adv Pharm Bull. 2013; 3(2):273-6.
- Arablou T et al. The effect of ginger consumption on glycemic status, lipid profile, and some inflammatory markers in patients with type 2 diabetes mellitus. 摄入生姜对2型糖尿病患者血糖状态、血脂和某些炎症指标的影响 Int J Food Sci. 2014; 65(4):515-20.
- Wu J et al. Quercetin, luteolin, alleviate TXNIP and NLRP3-mediated inflammation and apoptosis with regulation of AMPK in endothelial cells. 槲皮素、木犀草素通过调节内皮细胞中的AMPK减轻TXNIP和NLRP3介导的炎症和细胞凋亡 Eur J Pharmacol. 2014; 745:59-68.
- Vasquez Prieto MA et al. Catechin and quercetin attenuate adipose inflammation in 3T3-L1 adipocytes. 儿茶素和槲皮素可减轻3T3-L1脂肪细胞中的脂肪炎症 Mol Nutr Food Res. 2015; 59(4):622-33.
- Dower JI et al. Supplementation of the pure flavonoïds epicatechin and quercetin affects some biomarkers of endothelial dysfunction and inflammation in hypertensive adults: a randomized double-blind placebo controlled crossover trial补充纯黄酮表儿茶素和槲皮素会影响高血压成年人内皮功能障碍和炎症的某些生物标志物:一项随机双盲安慰剂对照交叉试验. J Nutr 2015; 145(7):1459-63.
- Svajger U et Jeras M. Antiinflammatory effects of resveratrol and its potential use in therapy of immune-mediated diseases. 白藜芦醇的抗炎作用及其在免疫介导疾病治疗中的潜在应用 Int Rev Immunol. 2012; 31(3):202-22.
- Bollmann F et al. Resveratrol post-transcriptionally regulates pro-inflammatory gene expression via regulation of KSRP RNA binding activity. 白藜芦醇在转录后通过调节KSRP RNA结合活性来调节促炎基因的表达 Nucleic acids Res. 2014; 40(20):12555-69.
- Chang YP et al. Resveratrol inhibits NLRP3 inflammasome activation by preserving mitochondrial integrity and augmenting autophagy. 白藜芦醇通过保持线粒体完整性并增强自噬来抑制NLRP3炎性体激活 J Cell Physiol. 2015; 230(7):1567-79.
- Ren Z et al. Resveratrol inhibits NFkB signaling through suppression of p65 and IkB kinase activities. Pharmazie. 2013; 68(8):689-94.
- Ghanim H et al. An anti-inflammatory and reactive oxygen species suppressive effects of an extract of polygonum cuspidatum containing resveratrol. 白藜芦醇通过抑制p65和IkB激酶活性抑制NFkB信号传导 J Clin Endocrinol Metab. 2010; 95(9):E 1-8.
- Tome-Carneiro J et al. One-year supplementation with a grape extract containing resveratrol modulates inflammatory-related microRNAs and cytokines expression in peripheral blood mononuclear cells of type 2 diabetes and hypertensive patients with coronary artery disease. 一年补充含有白藜芦醇的葡萄提取物可调节2型糖尿病和冠心病高血压患者外周血单个核细胞中炎症相关的microRNA和细胞因子的表达 Pharmacol Res. 2013; 72:69-82.
- Ghanim H et al. A resveratrol preparation suppresses oxidative and inflammatory stress response to a high fat high carbohydrate meal. 白藜芦醇制剂可抑制对高脂高碳水化合物膳食的氧化和炎症应激反应 J Clin Endocrinol Metab. 2011; 96(5):1409-14.
- Yeh JL et al. Eugenol suppress LPS induced iNOS expression by down regulating NF-kappa B and AP1 through inhibition of MAPKs and AKT/IkBα signaling pathways in macrophages. 丁香油酚通过抑制巨噬细胞中的MAPKs和AKT /IkBα信号通路来下调NF-κB和AP1,从而抑制LPS诱导的iNOS表达 Int J Immunopathol Pharmacol. 2011; 24(2):345-56.
- Pan C et al. Antiasthmatic effects of eugenol in a mouse model of allergic asthma by regulation of NF-kB pathway; 丁香油酚通过调节NF-kB途径对过敏性哮喘小鼠的哮喘作用 inflammation. 2015; 38(4):1385-93.
- Abd El Motteleb DM et al. Differential effects of eugenol against hepatic inflammation and overall damage. 丁香酚对肝脏炎症和整体损伤的差异作用 J immunotoxicol. 2014; 11(3):238-45.
- Kaur G et Sultana S. Evaluation of antiarthritic activity of isoeugenol in adjuvant induced arthritis in murine model. 异丁香酚在佐剂性关节炎小鼠模型中的抗关节炎活性评估 Food Chem Toxicol. 2012; 50(8):2869-95.
- Ammon JP. Boswellic acids in chronic inflammatory diseases. 乳香酸在慢性炎症性疾病中的应用 Planta Med. 2006; 72(12):1100-16.
- Siddiqui MZ. Boswellia serrata, a potential anti-inflammatory agent: an overview. 概述:齿叶乳香作为潜在的抗炎药 Indian J Pharm Sci. 2011; 73(3):255-61.
- Catanzaro D et al. Boswellia serrata preserves intestinal epithelial barrier from oxidative and inflammatory damage. 齿叶乳香可保护肠上皮屏障免受氧化和炎性损害 PLoSOne 2015; 10(5):e0125375.
- Sengupta K el al. A double blind, randomized placebo controlled study of the efficacy and safety of 5-loxin for treatment of osteoarthritis of the knee. 5-loxin治疗膝盖骨关节炎的有效性和安全性的双盲随机安慰剂对照研究。Arthritis Res Ther. 2008; 10(4):R85.
- Gupta I et al. Effects of gum resin of Boswellia serrata in patients with chronic colitis. 齿叶乳香树脂在慢性结肠炎患者中的作用Planta Med. 2001; 67(5):391-5.
- Gupta I et al. Effects of gum resin of Boswellia serrata in patients with bronchial asthma: results of a double blind, placebo controlled, 6 weeks clinically study. 齿叶乳香树脂对支气管哮喘患者的作用:双盲,安慰剂对照,6周临床研究的结果Eur J Med Res. 1998; 3(11):511- 14I.
- Ammon JP. Modulation of the immune system by Boswellia serrata extracts and boswellic acids. 齿叶乳香提取物和乳香酸对免疫系统的调节 Phytomedecine. 2010; 17(11):862-7.
- Duntas LH. Selenium and inflammation: underlying anti-inflammatory mechanisms. 硒和炎症:潜在的抗炎机制 Horm Metab Res. 2009; 41 (6): 443-7.
- Mattmiller SA et al.Regulation of inflammation by selenium and selenoproteins: impact on eicosanoid biosynthesis. 硒和硒蛋白对炎症的调节:对类花生酸生物合成的影响。 J Nutr Sci. 2013; 2:e28.
- Bonaventura P et al. Zinc and its role in immunity and inflammation. 锌及其在免疫和炎症中的作用 Autoimmun Rev. 2015; 14(4):277-85.
- Prasad AS. Zinc is an antioxidant and anti-inflammatory agent: its role in human health. 锌作为抗氧化剂和消炎剂在人类健康中的作用 Front Nutr. 2014.


发表评论
Want to join the discussion?Feel free to contribute!